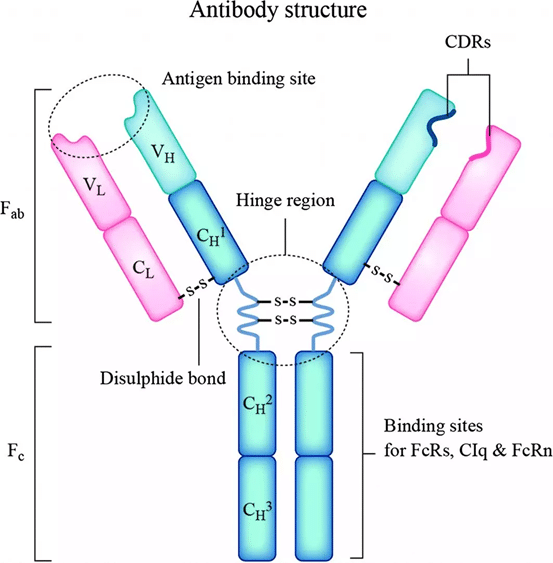
体液免疫(B細胞)と細胞性免疫(T細胞)は、それぞれBCRとTCR受容体を介して特異性に対処し、後天的な免疫システムの中心的な役割を果たしています。B細胞は成熟したプラズマ細胞に分化する際に抗体を分泌し、遊離抗体はFabを介して抗原と結合し、Fc effector効果(ADCC、ADCP、CDC)を介して標的細胞を攻撃します 。
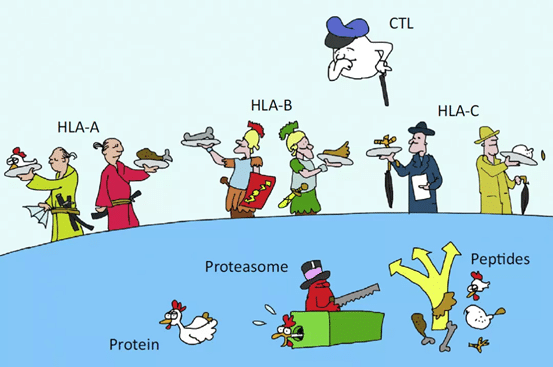
T細胞は提示細胞から提示されたポリペプチドをTCRを介してMHCを介して認識し、T細胞自身が結合後に攻撃し、CD8 T細胞は直接殺傷作用を発揮し、CD4 T細胞(Th1, Th2, Th17, Treg, Tfh)は異なるサイトカインを介して対応する免疫調節作用を発揮し、Tregは陰性調節作用を発揮し、TfhはT/B細胞相互作用を媒介します(これはT細胞のエピトープがタンパク質-薬物免疫原性に影響を与えるという理論的根拠にもなっています)。
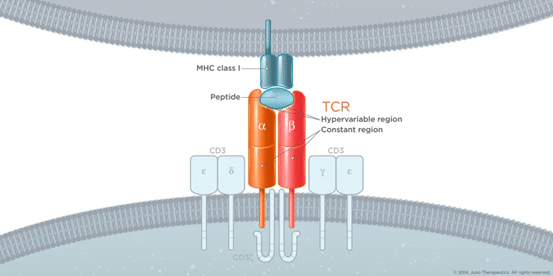
TCRは遊離タンパク質であるIgGとは異なり、膜タンパク質であるため、主に標的抗原に対する治療薬として使用されてきました。長い間、IgGは主に標的抗原に対する治療薬として使用されてきました。近年のT細胞療法の発展に伴い、TCR-Tも重要な方向性となっており、Adaptimmuneは固形腫瘍における初期のブレークスルーを果たしました。TCRは、細胞内標的に作用するペプチド-MHC複合体を認識しているため、理論的には抗体IgGとは異なる大きな可能性を秘めた治療法である。しかし、TCRの標的がMHC遺伝子型に限定されていることもあり、現段階でのTCR-T治療はMHC遺伝子型に依存しない標的を主に研究しており、実際にはごく限られた範囲のTCR治療となっています。より深いメカニズムを見ると、腫瘍ネオアンチゲンは、精密治療にアクセスするためのTCR治療の重要なエントリーポイントになり得るが、この分野はまだ比較的実現には程遠いです(ただし、UW Genentechはネオアンチゲンを標的とした自己免疫性T細胞を宣言しています)。
自己免疫性T細胞療法での初期抗原の標的化とは、個別化された初期抗原の同定と高度に特異的なTCRのスクリーニングを同時に行うことを意味します。CAR-T療法とは対照的に、大規模な拡張とその後の自家T細胞の注入は数桁の困難さがあります。技術的な難しさもコストも受け入れがたいものであり、実現可能性についてはさらなる検証が必要である。再生エレメンツは、新しい技術プラットフォームにより、TCRを抗体IgGに置き換えることで、新しい視点からのTCR治療を可能にします。簡単に説明すると、このスクリーンは、MHC-ペプチド複合体を高親和性で結合するIgGに特異的である。下の図では、スクリーニングされた抗体は、HLA-A2を提示するHPVペプチド複合体を特異的に認識しています。
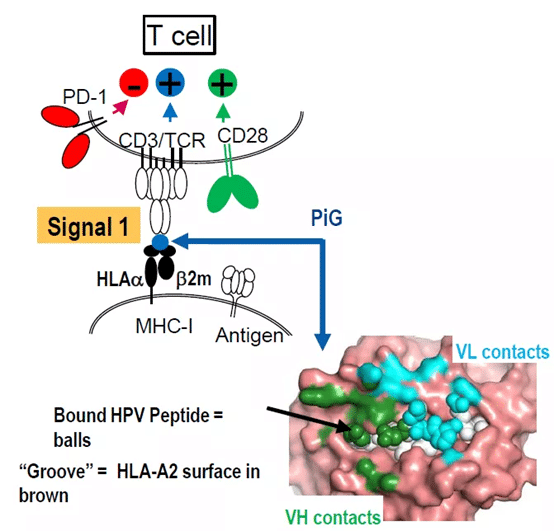
PiG技術プラットフォームの実装は、非ヒト動物のHLAヒト化に基づいて、控えめに言っても比較的簡単です。具体的には、メタジェニック全ヒト抗体トランスジェニックマウスの再生に基づいて、HLA-A2などの特定のHLA部位をヒト化します(すなわち、免疫グロブリンの可変領域をヒト化することである)。マウスはHLA-A2をヒト化しているため、免疫寛容性を発現し、HLA-A2を認識する抗体を発現していません。その後、マウスをHLA-A2/ペプチドで免疫し、「非自己」のHLA-A2/ペプチドに抵抗性になります。ペプチドに特異的な抗体を生成します。その後、HLA-A2/HPVペプチドを特異的に認識するようにスクリーニングしたが、ヌルのHLA-A2とは結合しませんでした。
実は以前にも似たような技術がありました、ImmunoCore社が開発したImmTAC技術プラットフォーム、抗CD3 TCRは特異的認識を担当し、抗CD3 scFvはT細胞のリクルートと活性化を担当しています。TCRのもう一つの利点は、MHC-ペプチド複合体の親和性および溶解性を大幅に高めるように修飾されていることである。