記者 尾尻和紀 報道
2020年7月9日、デンマークのレオ製薬は、成人の中等度から重度のアトピー性皮膚炎(湿疹)の治療薬としてIL-13モノクローナル抗体トラロキヌマブの販売承認申請が、2021年第2四半期のPDUFA期日をもってFDAに受理されたことを発表しました。
また、EMAは、現在CHMPの審査中であるトラロキヌマブのマーケティング申請を受理しています。Tralokinumabは、世界初のIL-13モノクローナル抗体として上市申請を行っており、IL-13が承認された最初の治療薬として期待されています。承認されれば、現在のゴールドスタンダードであるIL-4Rαモノクローナル抗体Dupixentを中等度から重度のアトピー性皮膚炎の治療に使用することが可能となる13のモノクローナル抗体です。

Tralokinumab社は、アトピー性皮膚炎(湿疹)などのアレルギー性疾患において重要な役割を果たすTh2経路のキードライバーの一つであるIL-13を標的とした完全ヒト型モノクローナル抗体であり、IL-13シグナル伝達経路を阻害することでアトピー性皮膚炎の治療が期待されています。
トラロキヌマブは、アトピー性皮膚炎(湿疹)などのアレルギー性疾患において重要な役割を果たすTh2経路のキードライバーの一つであるIL-13を標的とした完全ヒト型モノクローナル抗体であり、IL-13シグナル伝達経路を阻害することでアトピー性皮膚炎の治療が期待されています。
BLA申請は、「ECZTRA 1」「ECZTRA 2」「ECZTRA 3」の3つの枢要臨床試験、「ECZTRA 1」「ECZTRA 2」は52週間の単剤臨床試験、「ECZTRA 3」は32週間の外用グルココルチコイドとの併用臨床試験で、それぞれ802名、794名、380名が登録されており、安全性と有効性のデータに基づいています。
レオ ファーマ株式会社は2019年12月11日、ECZTRA 1、ECZTRA 2、ECZTRA 3の3つの第3相臨床試験がすべての主要評価項目と副次評価項目を満たし、全体的な安全性プロファイルはプラセボと同様であったと発表したが、具体的なデータは発表されませんでした。
IL-4とIL-13は、Th2経路の主要なドライバーであり、湿疹治療に重要な役割を果たしています。ただし、現在承認されているのはIL-4Rα(IL-4/IL-13)モノクローナル抗体「デュピセント」のみ、2020年6月 NMPAは5月17日、中国でのダピトール(一般名:デュプリマブ)の発売を承認しました。
上市申請中のTralokinumabに加え、別のIL-13モノクローナル抗体であるレブリキズマブも2019年10月17日に第2b相臨床データを発表しており、デュピセントと比較して全体的に非劣性であり、4週間投与の可能性があり、結膜炎のリスクが有意に低いことに加えて、結膜炎のリスクが有意に低いことを示しています。
Lebrikizumabのポテンシャルに基づき、2020年1月10日、リリーはDermiraを現金11億ドルで買収しました。
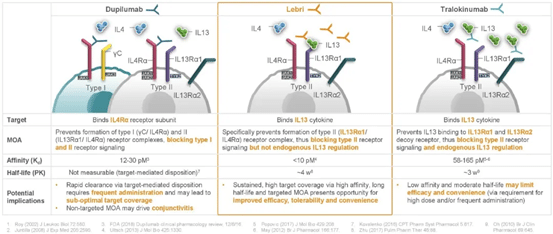
レブリキズマブは、高親和性のIL-13モノクローナル抗体で、IL-13Rα1/IL-4Rαヘテロ二量体の形成とその後のシグナル伝達を阻害し、IL-13の生物学的作用を阻害します。
IL-4Rα抗体Dupixentは、I型受容体(γC/ IL4Rα)とII型受容体((IL13Rα1/ IL4Rα)シグナル伝達経路の両方をブロックするのとは異なり、IL-13抗体LebrikizumabはII型受容体((IL13Rα1/ IL4Rα)シグナル伝達経路)のみをブロックし、内因性のIL-13調節はブロックしません。I型受容体(γC/IL4Rα)シグナル伝達経路の遮断が、デュピセントの特徴的な結膜炎の副作用の原因となっている可能性があります。
また、トラロキヌマブはII型受容体シグナル伝達経路のみを阻害するが、レブリキズマブよりも低い親和性と半減期で内因性のIL-13調節を阻害します。
記者 尾尻和紀 報道