2020年5月6日、FDAはノバルティス ファーマ社のCapmatinibのMET14エクソン変異を有する進行非小細胞肺がん(NSCLC)治療薬としての承認を、PDUFAの期日を3ヶ月前倒しした。CapmatinibはFDA承認の初のMET阻害剤、今後はTabrectaという名前で販売されることになり、ノバルティス ファーマ社はTabrectaの価格を28日間の治療で17,950ドルとした。
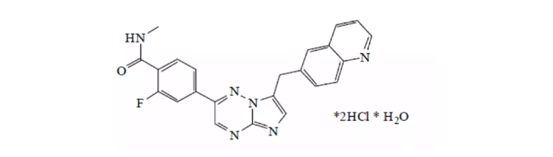
CapmatinibはIncyte社が開発し、2009年にノバルティス ファーマ社にライセンス供与された。Incyte社は7000万ドルのマイルストンとIPO後の売上高の12~14%のシェアを獲得する予定で、Jakafiに続く両社のもう一つの重要な協業である。NSCLCは非小細胞肺がんの約3~5%を占めており、毎年約4000~5000の患者がこの変異で診断されている。
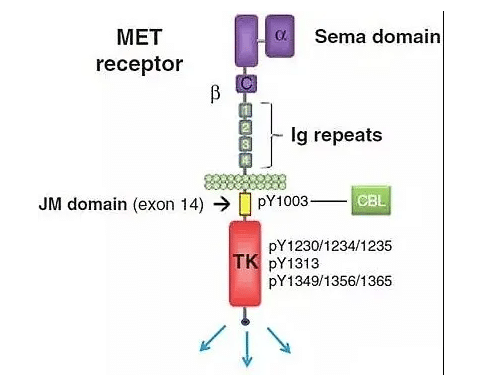
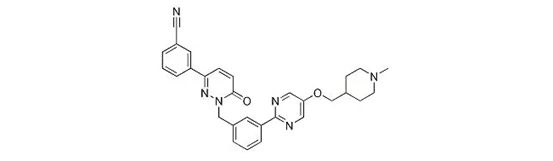
Capmatinibの主な競合は、ドイツのメルク社の「Tepotinib」で、日本では3月25日に承認され、治療奏効率42.4%の世界初のMET阻害剤となった。米国では今回、CapmatinibがTepotinibに先行している。
今回、FDAはCapmatinibをファーストライン治療とポストライン治療で承認したが、どんな治療を受けていたかに関係なくCapmatinibが使用できることを意味している。非小細胞肺がんの標的療法のリストにもう一つの標的がある。
記者 尾尻和紀 報道